Physique et Chimie : Tronc Commun
Semestre 2 Devoir 3 Modèle 2
Professeur : Mr EL GOUFIFA Jihad
Exercice 1 (9 pts)
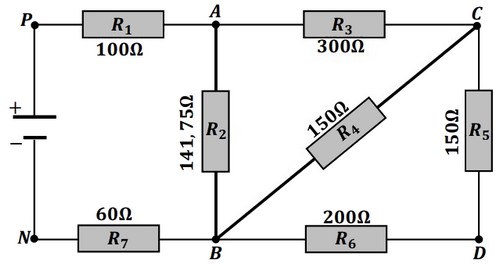
On considère le circuit électrique qui contient sept conducteurs ohmiques et un générateur de tension continue :
On donne la charge élémentaire :
- Montrer sur le schéma le sens du courant électrique dans chaque branche.
- Comparer les potentielles et et représenter sur le schéma les tensions , , et .
- Montrer en cinq étapes que la valeur de la résistance équivalente du circuit est , donner le schéma du circuit équivalent et en déduire l’intensité du courant électrique qui traverse le conducteur ohmique de résistance .
- Calculer la quantité d’électricité débitée en et en déduire le nombre des électrons traversant une section du conducteur pendant ce temps.
- Calculer les tensions , et .
- Calculer l’intensité du courant qui traverse le conducteur ohmique de résistance .
- Déterminer l’intensité du courant .
Pour mesurer l’intensité du courant qui traverse le conducteur ohmique de résistance , on branche un ampèremètre à aiguille de classe réglé sur le calibre et qui comporte divisions, sachant que l’aiguille de l’ampèremètre indique la division .
- Montrer sur la figure comment on doit brancher l’ampèremètre et calculer la valeur de l’intensité .
- Donner un encadrement de la valeur mesurée de l’intensité .
- Donner la précision de la valeur mesurée.
- En utilisant la loi d’additivité des tensions dans le circuit fermé , la loi d’Ohm et la loi des nœuds aux nœuds et , montrer que l’expression de l’intensité du courant qui traverse le conducteur ohmique de résistance s’écrit :
- Comparer sans aucun calcul les intensités du courant et . Justifier votre réponse.
On remplace le conducteur ohmique de résistance par un fil de connexion :
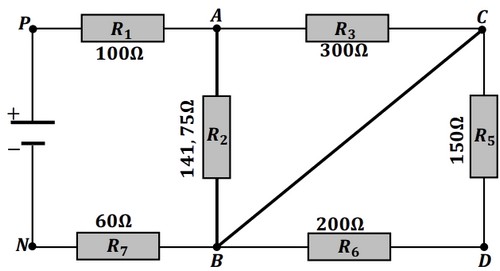
- Représenter le nouveau le sens du courant dans le circuit.
- Montrer que la résistance équivalente du circuit s’écrit :
Exercice 2 (4 pts)
Un circuit électrique comprend en série : un générateur de tension, un conducteur ohmique de résistance et un oscilloscope branché aux bornes du conducteur ohmique.
L’oscilloscope est réglé comme suit :
- Sensibilité verticale :
- Sensibilité horizontale :
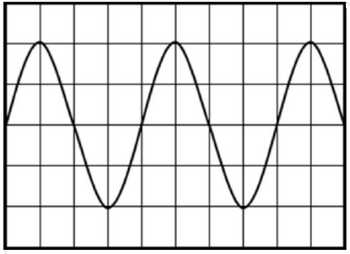
- Quelle est la nature de la tension observée ?
- Déterminer la période de cette tension.
- Déduire la fréquence de cette tension.
- Déterminer la valeur maximale de la tension.
- Déterminer la tension efficace de cette tension.
Exercice 3 (3,5 pts)
On considère la réaction dangereuse entre le sodium et l’eau. Dans un vase contenant un volume d'eau on introduit une masse de sodium.
L’équation modélisant cette réaction est :
- Calculer en les quantités de matière initiales et des deux réactifs.
- Dresser le tableau d’avancement de cette réaction.
- Déterminer l’avancement maximal de cette réaction et déduire le réactif limitant.
- Donner le bilan de la matière à l’état final.
- Le mélange est-il stœchiométrique ? Justifier votre réponse.
- Déterminer à l’état final, la concentration des ions et le volume du gaz dégagé
Données
- Masses molaires atomiques : et et
- Masse volumique de l’eau :
- Volume molaire :
Exercice 4 (3,5 pts)
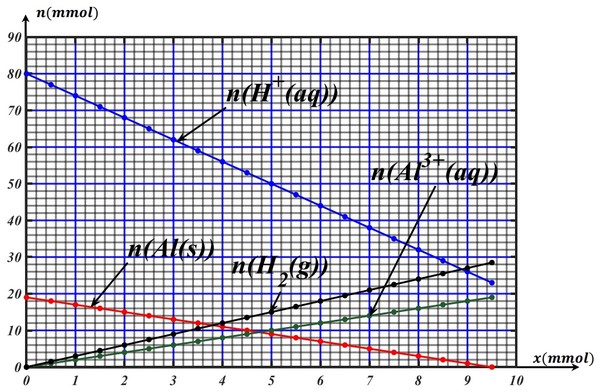
La réaction entre un ion et un solide produit un dégagement d’un gaz et des ions .
L’équation chimique de la réaction modélisant la transformation chimique est de la forme :
Dans un bécher on met une solution de volume d’un acide qui contient l’ion dont la concentration initiale en est et on introduit une masse du réactif .
- Calculer en (milli mol) les quantités de matière initiales des réactifs et .
- Déterminer du graphe les formules chimiques des réactifs et et les produits et .
- Trouver graphiquement les coefficients stœchiométriques et et écrire l’équation de la réaction.
- Déterminer graphiquement l’avancement maximal et en déduire le réactif limitant.
- Faire le bilan de la matière à l’état final.
- Déterminer le volume de gaz formé et la concentration des cations présent dans le bécher à l’état final.
Données
- Masse molaire de l’élément B :
- Volume molaire :