
Physique et Chimie : 1ère Année Bac SM
Semestre 1 Devoir 3 Modèle 1
Professeur : Mr EL GOUFIFA Jihad
I- Exercice 1 (6 pts)
Un solide (S), de masse m=5kg, glisse sur un plan incliné d’angle α=30° par rapport au plan horizontal.
Le solide (S) est lâché du point A sans vitesse initiale, après un parcourt de sa vitesse devient VB= 5m/s :
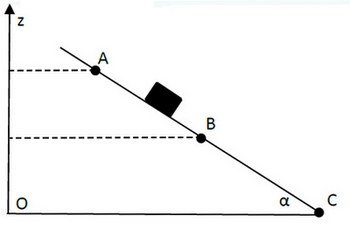
Donnée : g=10N/kg ; BC=15m ; AB=10m
- Calculer l’énergie cinétique au point B.
- Calculer le travail du poids entre A et B.
- En appliquant le théorème de l’énergie cinétique, Montrer que le mouvement se fait avec frottement entre A et B.
- Calculer le travail de la force des frottement f entre A et B, et déduire son intensité.
On considère le plan horizontal passant par B comme état de référence de l’énergie potentielle de pesanteur (Epp) ; et O comme origine de l’axe des côtes orienté vers le haut.
- Montrer que l’expression de Epp est : Epp=mg(z-zref)= m.g.(z-BC.sinα)
- Calculer les valeurs de Epp dans les positions A, B et C.
- Calculer la variation de l’énergie potentiel entre A et C, et déduire le travail du poids
II- Exercice 2 (5 pts)
Un calorimètre adiabatique contient une masse d’eau m1= 50g à la température θ1=20°C, on ajoute dans ce calorimètre une masse d’eau chaude m2= 50g à la température θ2=70°C, après agitation la température se stabilise à θf=40°C.
- Calculer Q2 la quantité de chaleur cédée par l’eau chaude.
- En déduire μ la capacité thermique du calorimètre.
On ajoute au mélange précédent à la température θf un morceau de glace de masse mg=40g à la température θg=-7,5°C, la température du mélange à l’équilibre est θ'.
- Calculer la quantité de chaleur cédée par l’eau et le calorimètre.
- Exprimer la quantité de chaleur reçue par le morceau de glace, en déduire la chaleur latente de fusion de la glace.
Pour déterminer le métal constituant un objet de masse , on chauffe cet objet jusqu’à la température et on l’ajoute au mélange précédent, la température d’équilibre maintenant est .
- Calculer la chaleur massique de l’objet métallique.
- En utilisant le tableau suivant déterminer le métal constituant l’objet étudié.
| Métal | Aluminium | Fer | Cuivre | Étain | Plomb |
| Chaleur massique (J.kg-1.K-1) | 878 | 460 | 397 | 226 | 130 |
Données :
- La chaleur massique de l’eau liquide :
- La chaleur massique de la glace :
III- Exercice 3 (5 pts)
A , on mélange un volume d’une solution aqueuse de bromure de potassium , de concentration molaire , avec un volume d’une solution aqueuse d’iodure de sodium , de concentration molaire .
On note le volume total du mélange.
- Donner l’expression littérale puis calculer la quantité de matière de chaque ion du mélange.
- Déterminer la conductivité de la solution .
- Déterminer la conductivité de la solution .
- Donner l’expression littérale puis calculer la concentration molaire de chaque ion du mélange en . (Dans le mélange total)
- Quelle est la relation entre la conductivité du mélange final et , , et . Calculer .
- Calculer la conductivité du mélange réalisé à partir de de et de .
Données :
IV- Exercice 4 (4 pts)
On introduit une masse d'hydrogénocarbonate de sodium, de formule , dans un erlenmeyer et on ajoute progressivement de l'acide chlorhydrique (solution aqueuse de chlorure d'hydrogène).
- Quels sont les couples acide/base mis en jeu ?
- Donner la demi-équation acido-basique relative à chaque couple.
- Écrire l'équation de la réaction qui se produit dans l'erlenmeyer. Donner le nom du gaz qui se dégage au cours de la transformation.
- Quel volume d'acide chlorhydrique de concentration faut-il verser pour que le dégagement de gaz cesse ( pour que la reaction est stoechiométrique) ?
- Quel est alors le volume de gaz dégagé si le volume molaire dans les conditions de l'expérience est ?
On donne :


