
Physique et Chimie : 1ère Année Bac
Séance 13 (Les réactions d'oxydo-réduction)
Professeur : Mr EL GOUFIFA Jihad
Sommaire
I- Notion de réactions d'oxydo-réduction
1-1/ Expérience
1-2/ Définitions
1-3/ Oxydants et réducteurs dans la classification périodique des éléments chimique
II- Couple oxydant / réducteur
2-1/ Définition
2-2/ Exemples
III- Réaction d’oxydo-réduction
3-1/ Demi-équation d’oxydo-réduction
3-2/ Réactions d’oxydo-réduction
IV- Exercices
4-1/ Exercice 1
4-2/ Exercice 2
4-3/ Exercice 3
4-4/ Exercice 4
I- Notion de réactions d'oxydo-réduction
1-1/ Expérience
On immerge une plaque de zinc dans une solution de sulfate de cuivre II :
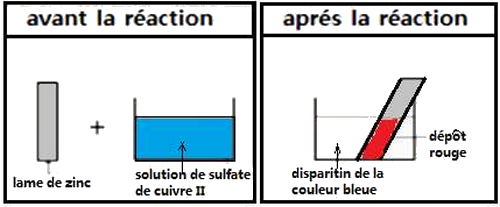
On observe un dépôt rouge de cuivre et la décoloration de la solution.
L’addition de la soude fait apparaître un précipité blanc ce qui implique la présence des ions Zn2+ dans la solution.
L’équation de la réaction peut alors s’écrire :
Zn(s)+Cu2+(aq)⇄
Chaque atome de zinc se transforme en ion zinc par perte de deux électrons, on écrira :
L’ion cuivre II capte deux électrons pour se transformer en atome , on écrira :
Au cours de cette réaction il y’a transfert d’électrons entre l’atome de zinc et l’ion cuivre II.
Il caractérise une réaction d’oxydo-réduction.
I- Notion de réactions d'oxydo-réduction
1-2/ Définitions
Oxydation et réduction
Une oxydation est une réaction chimique au cours de laquelle une espèce chimique un oxydant perd un ou plusieurs électrons.
Une réduction est une réaction chimique au cours de laquelle une espèce chimique un réducteur gagne un ou plusieurs électrons.
Oxydant et réducteur
Un oxydant est une espèce chimique susceptible de capter un ou plusieurs électron(s).
Un réducteur est une espèce chimique susceptible de perdre un ou plusieurs électron(s).
I- Notion de réactions d'oxydo-réduction
1-2/ Définitions
Réaction d’oxydo-réduction
On appelle une réaction qui met en jeu un transfert d’électrons entre un oxydant et un réducteur, une réaction d’oxydo-réduction.
Exemple :

Une oxydation transforme un réducteur en son oxydant conjugué.
Une réduction transforme un oxydant en son réducteur conjugué.
II- Couple oxydant / réducteur
2-1/ Définition
Un couple oxydant / réducteur est un ensemble formé par un oxydant et un réducteur qui se correspondent dans la même demi-équation redox :
II- Couple oxydant / réducteur
2-2/ Exemples
| Couple | Oxydant | Réducteur | Demi-équation rédox |
| Ion hydrogène | Dihydrogène | ||
| Cation métallique | Métal | ||
| Ion fer (III) | Ion fer (II) | ||
| Diiode | Ion iodure | ||
| Ion tétrathionate | Ion thionate |
III- Réaction d’oxydo-réduction
3-1/ Demi-équation d’oxydo-réduction
L’écriture des demi-équations redox est basée sur les lois de conservation des éléments et des charges électriques.
Exemple 1
La conservation de la charge électrique est assurée par les électrons.
Exemple 2
La conservation de l’oxygène nécessite l’intervention de l’eau et les ions ou .
III- Réaction d’oxydo-réduction
3-2/ Réactions d’oxydo-réduction
Une réaction d’oxydo-réduction met en jeu deux couples redox. Elle consiste en un transfert d’un ou plusieurs électron(s) du réducteur de l’un des couples à l’oxydant de l’autre couple.
Les électrons n’apparaissent pas dans l’équation de la réaction.
On écrira pour les deux couples et :
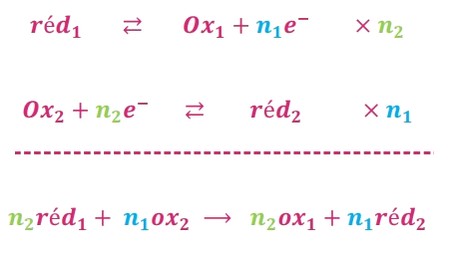
IV- Exercices
4-1/ Exercice 1
- Écrire les demi-équations électroniques des couples Oxydant/Réducteur suivants :
On donne l’équation suivante :
- Identifier les couples ox/red mis en jeu et écrire les demi-équations correspondantes.
- Quelle espèce joue le rôle : a) d’oxydant ? b) de réducteur ?
- Quelle espèce subit : a) l’oxydation ? b) la réduction ?
IV- Exercices
4-2/ Exercice 2
On émerge une plaque de zinc Zn dans une solution de nitrate d’argent de volume et de concentration , et on obtient un dépôt d’argent sur la partie immergée de la plaque de zinc et formation des ions .
- Donner la demi-équation d’oxydoréduction correspondant à chacun des couples et , puis déduire l’équation bilan.
- Déterminer la quantité de matière initiale des ions .
- Sachant que le zinc est utilisé par excès, tracer le tableau d’avancement et déterminer l’avancement maximum.
- Déterminer la masse d’argent déposée à la fin de la réaction sur la plaque de zinc.
- Déterminer la masse de zinc qui a réagi.
- Quelle est la concentration des ions dans la solution obtenue à la fin de la réaction ?
Données :
IV- Exercices
4-3/ Exercice 3
Une solution de sulfate de fer II est préparée par dissolution de de soluté de façon à préparer un volume .
La solution est abandonnée à l’air, une partie des ions fer II a été oxydé en ions fer III, on désigne par la nouvelle solution.
Pour déterminer le pourcentage des ions fer II oxydés par l’air on procède de la manière suivante : On prélève un volume de la solution au quel on ajoute quelques gouttes d’acide sulfurique, et on le fait réagir avec une solution de permanganate de potassium de concentration .
Il a fallut versé de la solution pour faire régir tous les ion fer II.
- Calculer le nombre de mol d’ions fer II dans .
- Déterminer la concentration de la solution .
- Calculer la masse de permanganate de potassium utilisée pour préparer de .
- Écrire les équations d’oxydation et de réduction et déduire l’équation bilan de la réaction redox qui se produit.
- Déterminer le nombre de mole d’ions fer II dans .
- Calculer le pourcentage de mole d’ions fer II qui ont été oxydés par l’air.
DONNÉES:
IV- Exercices
4-4/ Exercice 4
On introduit une masse de poudre d’aluminium dans un volume de solution d’acide chlorhydrique de concentration .
Des ions aluminium (III) se forment et du dihydrogène se dégage.
- Écrire l’équation de la réaction d’oxydoréduction qui traduit la transformation observée.
- Quelle espèce chimique joue le rôle d’oxydant ? de réducteur ?
- Quelle espèce chimique est oxydée ? réduite ?
- Construire le tableau d’avancement, en déduire la composition finale en quantité de matière du système étudié.
- Quel est le volume de dihydrogène dégagé dans les conditions de l’expérience à la température de sous la pression de ?
Données :
- Couples :
- Masse molaire
- Constante des gaz parfaits :


