
Physique et Chimie : Tronc Commun
Séance 12 (La géométrie de quelques molécules)
Professeur : Mr EL GOUFIFA Jihad
Sommaire
I- Règles du DUET et de l’OCTET
1-1/ Structure des gaz rares
1-2/ La règle du duet
1-3/ La règle de l’octet
1-4/ Application sur les ions monoatomiques stables
II- Représentation de Lewis d’une molécule
2-1/ La molécule
2-2/ La liaison covalente
2-3/ La représentation de Lewis d’une molécule
III- Les formules des molécules
IV- Les isomères
V- Géométrie des molécules
5-1/ Géométrie spatiale des molécules
5-2/ Représentation de Cram
VI- Tableau périodique
VII- Exercices
7-1/ Exercice 1
7-2/ Exercice 2
7-3/ Exercice 3
7-4/ Exercice 4
I- Règles du DUET et de l’OCTET
1-1/ Structure des gaz rares
L'hélium He (Z=2), le néon Ne (Z=10) et l'argon Ar (Z=18) sont des éléments qui n'existent sur la nature que sous la forme d'atomes isolés.
Ce sont des gaz qui ne réagissent pas, ils sont qualifiés de «nobles».
| Atome | Numéro atomique | Structure électronique | Couche externe |
| L'hélium He | Z=2 | (K)2 | (K)2 |
| Le néon Ne | Z=10 | (K)2(L)8 | (L)8 |
| L'argon Ar | Z=18 | (K)2(L)8(M)8 | (M)8 |
Les gaz rares (ou gaz inertes) ne participent pas à des transformations chimiques, ils sont chimiquement stables, leurs couches externes sont saturées.
I- Règles du DUET et de l’OCTET
1-2/ La règle du duet
Au cours des transformations chimiques, les éléments chimiques de numéro atomique (Z≤4) évoluent de manière à avoir la structure électronique du Hélium He : (K)2.
Ils ont alors deux électrons sur leur couche externe.
I- Règles du DUET et de l’OCTET
1-3/ La règle de l’octet
Au cours des transformations chimiques, les éléments chimiques de numéro atomique (5≤Z≤18) évoluent de manière à avoir la structure électronique de plus proche gaz rare dans le tableau périodique des éléments (de Néon Ne : (K)2(L)8 ou Argon Ar : (K)2(L)8(M)8).
Ils portent donc 8 électrons sur leur couche externe.
I- Règles du DUET et de l’OCTET
1-4/ Application sur les ions monoatomiques stables
|
|
II- Représentation de Lewis d’une molécule
2-1/ La molécule
La molécule est des assemblages des atomes attachés les unes des autres.
La molécule est stable et électriquement neutre.
II- Représentation de Lewis d’une molécule
2-2/ La liaison covalente
Une liaison covalente simple est la mise en commun de deux électrons entre deux atomes, le doublet commun est appelé doublet liant (chaque atome y participe par un électron).
Remarque
On représente La liaison covalente par un trait (-) entre les symboles de deux atomes.
Exemples
- Liaison covalente simple : H-H
- Liaison covalente double : O=O
- Liaison covalente triple : N≡N
II- Représentation de Lewis d’une molécule
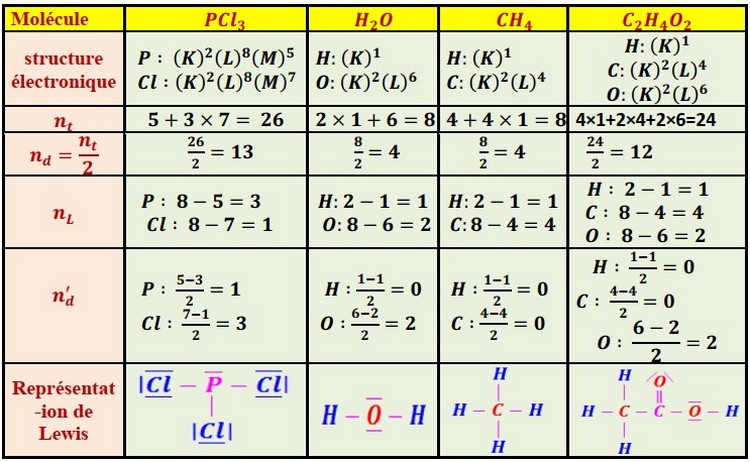
2-3/ La représentation de Lewis d’une molécule
Définition
La représentation de Lewis d’une molécule est une représentation des atomes et de tous les doublets d’électrons (liants et non-liants) de cette molécule.
Méthode
- Écrire la structure électronique de chaque atome.
- Déterminer le nombre global nt d’électrons de couches externes de chaque atome dans la molécules.
- Déterminer le nombre global nd de doublet d’électrons : nd=nt2
- Déterminer le nombre nL de liaison covalente que doit établir chaque atome pour acquérir une structure en octet (8-p) ou en duet (2-p) avec p est le nombre d’électrons d’équivalence.
- Déterminer le nombre n' de doublet non liants de chaque atome :
II- Représentation de Lewis d’une molécule
2-3/ La représentation de Lewis d’une molécule
Exemples
III- Les formules des molécules
Formules brute
Elle indique le symbole et le nombre des atomes présents.
- Exemple :
Formule développée
Elle fait apparaître toutes les atomes et toutes les liaisons entre les atomes de la molécule.
- Exemple :

Formule semi-développée
Elle indique les types de liaison entre les atomes principaux.
- Exemple :
IV- Les isomères
Définition
Les isomères sont des composés qui ont mêmes formules brutes mais des formules développées différentes (qui ont des propriétés physiques et chimiques différentes).
Exemple
La formule brute donne deux isomères :
- L’éthanol :
- L’oxyde de diméthyle :
V- Géométrie des molécules
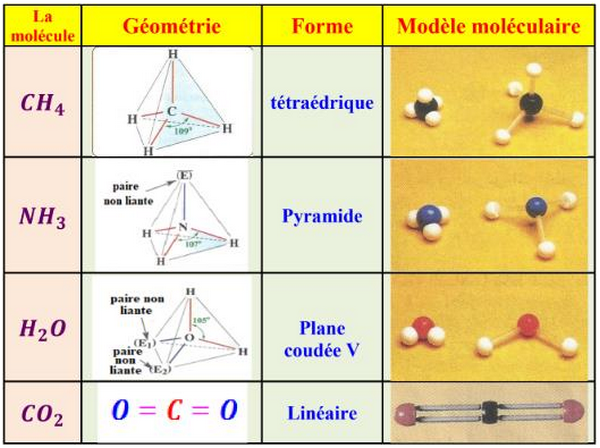
5-1/ Géométrie spatiale des molécules
La géométrie de la molécule résulte des répulsions entre les doublets liants et non liants qui se repoussent au maximum les uns des autres et la molécule prend une certaine disposition spatiale.
On trouve un atome central relié avec d’autres atomes par des liaisons covalentes.
V- Géométrie des molécules
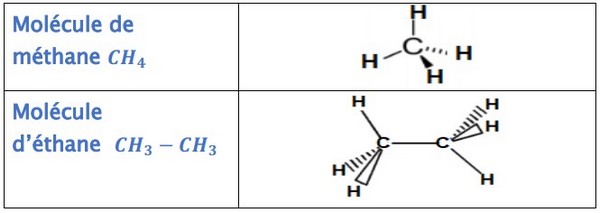
5-2/ Représentation de Cram
La représentation de Cram donne un aperçu de la configuration spatiale des atomes qui composent une molécule.
Elle fait apparaître les liaisons en perspective :

Exemples
VI- Tableau périodique

VI- Tableau périodique

VII- Exercices
7-1/ Exercice 1
Compléter le tableau suivant :
| Molécule | Atomes | Structure électronique |
Représentation de Lewis |
|||||
VII- Exercices
7-2/ Exercice 2
Soit le modèle moléculaire représentant la molécule d’éthanol :

- Écrire la formule brute de cette molécule.
- Écrire la formule développée de cette molécule et son schéma de Lewis.
- En déduire la formule semi-développée de cette molécule.
On considère l’atome de carbone ayant une liaison avec l’atome d’oxygène comme central.
- Faire la représentation de Cram de l’éthanol.
VII- Exercices
7-3/ Exercice 3
Les atomes
- Écrire les formules de Lewis des atomes suivants :
hydrogène - oxygène - carbone - azote - soufre - fluor
- Définir la liaison covalente.
- Définir la valence d’un élément. Préciser la valence des éléments précédents.
Les molécules
- Écrire les formules de Lewis des molécules suivantes :
- : Fluor d’hydrogène ;
- : sulfure d’hydrogène ;
- : dioxyde de carbone ;
- : méthane ;
- : diazote ;
- : éthanal.
La formule brute correspond à deux corps qui sont des isomères, les propriétés différentes
résultent d’une organisation différentes des atomes dans les deux molécules.
- Écrire les formules de Lewis correspondant à ces deux isomères.
VII- Exercices
7-4/ Exercice 4
- Définir les isomères.
- Donner toutes les formules semi-développée pour les isomères de la molécule .
- Donner la formule semi-développée de tous isomères des molécules suivantes :
On considère les 2 molécules suivantes :

- Donner la formule brute des molécules.
- Est-ce qu'il existe d'autres molécules ayant la même formule brute ?


