
Physique et Chimie : 2ème Année Bac
Séance 15 (Transformations liées à des réactions acide-base)
Professeur : Mr El GOUFIFA Jihad
Sommaire
I- Introduction
II- Autoprolyse de l’eau
2-1/ Définition
2-2/ Taux d’avancement final de la réaction d’autoprotolyse
III- Produit ionique de l’eau
IV- Constante d'acidité d'un couple acide-base
4-1/ Définition
4-2/ Relation entre le pH et pKA
4-3/ Constante d'équilibre associée à une réaction acido-basique
V- Comparaison des comportements des acides et des bases
5-1/ Comparaison des forces des acides
5-2/ Comparaison des forces des bases
VI- Espèce prédominante d'un couple acide/base
6-1/ Diagramme de prédominance
6-2/ Diagramme de distribution
6-3/ Les indicateurs colorés
VII- Exercices
7-1/ Exercice 1
7-2/ Exercice 2
7-3/ Exercice 3
7-4/ Exercice 4
I- Introduction
Le pH de l’eau d’un aquarium doit être maintenu entre 6,5 et 7,5 ; car la diminution du pH favorise la multiplication du nombre de quelques bactéries qui consomment le dioxygène dissout dans l’eau et l’augmentation du pH favorise la sédimentation du carbonate de calcium sur les feuille des plantes qui existent dans l’aquarium.
- Quelle sont les lois qui agissent sur les équilibres acido-basique ?
- Comment peut-on distinguer un couple acide/base ?
- Quels sont les principes du dosage acido-basique et comment le réalise-t-on ?
II- Autoprolyse de l’eau
2-1/ Définition
Dans l’eau pure se produit une transformation chimique limitée, on la modélise par ce qu’on appelle l’autoprolyse de l’eau, dont l’équation est :
2H2O(l)⇄H3O+(aq)+OH-(aq)
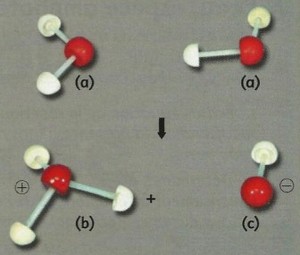
Cette réaction dans le sens direct s'appelle la réaction d'autoprotolyse de l'eau.
Cette réaction n’a pas lieu uniquement dans l’eau pure, mais dans toute solution aqueuse.
Le pH de l'eau pure à 25°C est pH=7, donc l'eau pure est électriquement neutre :
[H3O+] =[OH-]=10-7mol/L
II- Autoprolyse de l’eau
2-2/ Taux d’avancement final de la réaction d’autoprotolyse
Établissons le tableau d'avancement relatif à cette réaction :

L'avancement à l'équilibre, pour un volume V, vaut :
xéq=néq(H3O+)=[H3O+]éq.V
À 25°C, Pour un volume V=1,0L, on a xéq=10-7mol
L'avancement maximal vaut : xmax=ni2
La quantité initiale d’eau ni, dans un volume V, s’exprime grâce aux masses volumique μ0 et molaire M de l’eau : ni=μ0.VM
D'où : xmax=ni2=μ0.V2M
Pour V=1,0L, on a xmax=28mol
Le taux d'avancement final vaut alors :
τ=xéqxmax=3,6.10-9
Ce taux d'avancement final est très faible.
Conclusion
La réaction d’autoprotolyse de l'eau est très limitée.
III- Produit ionique de l’eau
La constante d’équilibre de la réaction d’autoprolyse est appelée produit ionique de l’eau et on la note Ke, elle est sans dimension et ne dépend que de la température.
La valeur de Ke est
Ke=[H3O+]éq .[OH-]éq
On définit aussi le pKe qui est lié au produit ionique par la relation suivante :
pKe=−logKe⇔Ke=10−pKe
On sait qu’à θ=25°C on a Ke=10-14 donc pKe=14.
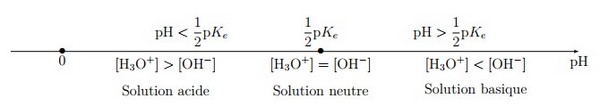
Échelle de pH :
IV- Constante d'acidité d'un couple acide-base
4-1/ Définition
Pour un couple acide-base A/B, la réaction de l'acide A avec l'eau s'écrit :
A(aq)+H2O(l)⇄B(aq)+H3O+(aq)
La constante d'acidité du couple acide-base A/B s'écrit :
KA=[B]éq×[H3O+]éq[A]éq
C'est une gradeur sans unité, qui ne dépend que de la température.
On utilise aussi le pKA qui est lié à la constante d'acidité par la relation suivante :
pKA=−logKA⇔KA=10−pKA

IV- Constante d'acidité d'un couple acide-base
4-2/ Relation entre le pH et pKA
D'après la relation de la constante d'acidité on a :
[H3O+]éq=[A]éq×KA[B]éq ⇒pH=-log[H3O+]éq⇒pH=-logKA.[A]éq[B]éq⇒pH=-logKA-log[A]éq[B]éq⇒pH=pKA+log[B]éq[A]éq
IV- Constante d'acidité d'un couple acide-base
4-3/ Constante d'équilibre associée à une réaction acido-basique
Pour le couple acide-base A1/B1 on a :
A1(aq)+H2O(l)⇄B1(aq)+H3O+(aq)
Sa constante d'acidité est :
KA1=[B1]éq×[H3O+]éq[A1]éq
Pour le couple acide-base A2/B2 on a :
A2(aq)+H2O(l)⇄B2(aq)+H3O+(aq)
Sa constante d'acidité est :
KA2=[B2]éq×[H3O+]éq[A2]éq
Dans la réaction acido-basique entre l'acide A1 du couple A1/B1 et la base B2 du couple A2/B2 est :
A1(aq)+B2(aq)⇄B1(aq)+A2(aq)
Sa constante d'équilibre est :
K=[B1]×[A2][A1]×[B2] =KA1KA2=10(pKA2-pKA1)
V- Comparaison des comportements des acides et des bases
5-1/ Comparaison des forces des acides
La réaction qui a lieu lors de la mise en solution d’un acide, noté HA, a pour équation :
HA(aq)+H2O(l)⇄A-(aq)+H3O+(aq)
Par définition, à concentration apportée égale, un acide est d’autant plus fort que le taux d’avancement final T de la réaction entre l’acide et l’eau est grand, donc c’est celui pour lequel [H3O+] est la plus élevée.
τ=xéqxmax=10-pH.VC.V=10-pHC
Conclusion
Pour une même concentration apportée d’acide, un acide est d’autant plus fort :
- que le pH de la solution est faible ;
- que la constante d’acidité KA du couple mis en jeu est grande et donc que le pKA est faible.

V- Comparaison des comportements des acides et des bases
5-2/ Comparaison des forces des bases
La réaction qui a lieu lors de la mise en solution d’une base, notée B, a pour équation :
B(aq)+H2O(l)⇄BH+(aq)+HO-(aq)
τ=xéqxmax=10(pH-pKA).VC.V=10(pH-pKA)C
Conclusion
Pour une même concentration apportée de base, une base est d’autant plus forte :
- que le pH de la solution est grand.
- que la constante d’acidité KA du couple mis en jeu est petite et donc que le pKA est grand.
VI- Espèce prédominante d'un couple acide/base
6-1/ Diagramme de prédominance
La relation pH=pKA+log[B]éq[A]éq, caractéristique d'un couple acide / base A/B, conduit à distinguer les trois cas suivants :
- pH=pKA⇒log[B][A]=0⇒[B]=[A] : L'acide et la base conjugués ont la même concentration.
- pH>pKA⇒log[B][A]>0⇒[B]>[A] : Le domaine de pH défini par pH>pKA est le domaine de prédominance de la base B.
- pH<pKA⇒log[B][A]<0⇒[B]<[A] : Le domaine de pH défini par pH<pKA est le domaine de prédominance de l’acide A.
Les diagrammes de prédominance présentés ci-dessous résument et illustrent ces résultats :


VI- Espèce prédominante d'un couple acide/base
6-2/ Diagramme de distribution
Le diagramme suivant appelé diagramme de distribution, présente, en fonction du pH, les pourcentages d'acide éthanoïque (courbe rouge), et de sa base conjuguée, l'ion éthanoate (courbe verte) en fonction du pH de la solution :
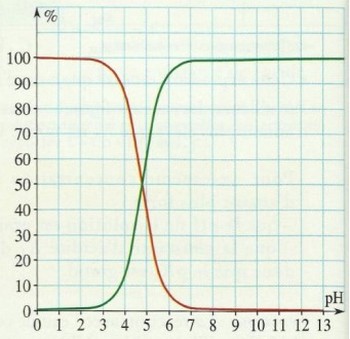
À l'intersection des deux graphes, les pourcentages des espèces CH3COOH et CH3COO- sont égaux et on lit : pH=pKA=4,8
VI- Espèce prédominante d'un couple acide/base
6-3/ Les indicateurs colorés
Les indicateurs colorés acido-basiques sont constitués par des couples acide/base dont les espèces conjuguées ont des teintes différentes.
Un indicateur coloré, constitué par le couple acide/base HInd/Ind-, est caractérisé par sa constante d'acidité correspondant à l’équation :
HInd(aq)+H2O(l)⇄Ind-(aq)+H3O+(aq)
Pour le couple HInd/Ind-, comme pour tout couple acide / base, on peut écrire :
pH=pKA+log[Ind-][HInd]
La teinte de l'indicateur dépend de l'espèce qui prédomine et donc du pH de la solution :
- Pour pH<pKA-1, l’indicateur a sa teinte acide.
- Pour pH>pKA+1, l’indicateur a sa teinte basique.
la figure suivante présente la teinte acide, teinte sensible et teinte basique du bleu de bromothymol (BBT) :


VII- Exercices
7-1/ Exercice 1
On prépare dans un laboratoire de chimie une solution aqueuse d’acide butanoïque C3H7COOH(aq) de volume V et de concentration molaire C=1.10-2mol.L-1.
Le pH de cette solution est pH=3,41.
On modélise la transformation produite par l’équation chimique suivante :
C3H7COOH(aq)+H2O(l)⇄C3H7COO-(aq)+H3O+(aq)
- Déterminer le taux d’avancement final de la réaction. En déduire.
- Trouver, en fonction de C et du pH, l’expression du quotient de réaction Qr,éq à l’équilibre, puis calculer sa valeur.
- En déduire la valeur du pKA du couple C3H7COOH/C3H7COO-.
VII- Exercices
7-2/ Exercice 2
L’acide hypochloreux a pour formule HClO(aq). Sa base conjuguée ClO-(aq) est appelée ion hypochlorite.
Le document suivant représente les pourcentages des espèces chimiques acide et base du couple HClO(aq)/ClO-(aq) en fonction du pH pour une solution :
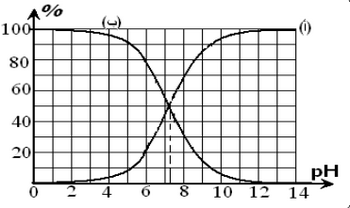
- Déterminer graphiquement la valeur numérique de la constante pKA du couple .
- Laquelle des deux courbes (a) ou (b) correspond à l'hypochlorite ?
- Montre que :
%HClO=[HClO][HClO]+[ClO-]=11+10pH-pKA
%ClO-=[ClO-][HClO]+[ClO-]=11+10pKA-pH
- Écrire l'équation de la réaction de HClO(aq) avec de l'eau.
On considère une solution d'acide hypochloreux de pH=5.
- Déterminer le taux d’avancement de la réaction dans la solution.
VII- Exercices
7-3/ Exercice 3
Nous mélangeons V1=20mL de solution aqueuse (S1) d'acide hypochloreux HClO(aq) de concentration C1=10-2mol/L avec le volume V2=10mL de solution aqueuse (S2) d'hydroxyde de sodium de concentration C2=C1.
On mesure le pH de la solution et on trouve pH=7,2.
À 25°C on a pKe=14. pKA=7,2
- Écrire l'équation de la réaction de l'acide hypochloreux avec les ions hydroxyde.
- Montrer que le taux d’avancement de la réaction s’écrit sous la forme τ=1-10PH-14C2(V1+V2V2), puis calculer sa valeur.
- Exprimer la constante d'équilibre K associée à la réaction d'acide hypochloreux et les ions hydroxyde en fonction de pKe et pKA (constante d'acidité de HClO(aq)/ClO-(aq)), puis calculer sa valeur.
- Que concluez-vous ?
VII- Exercices
7-4/ Exercice 4
On mélange dans un bécher un volume V1 de la solution aqueuse (S1) d’ammoniac NH3(aq) de concentration molaire C1 avec un volume V2=V1 d’une solution aqueuse de chlorure de méthyl ammonium (CH3NH+3(aq) ; Cl-(aq)) de concentration molaire C2=C1.
- Écrire l’équation chimique modélisant la réaction de l’ammoniac avec l’ion méthyl ammonium.
- Exprimer la constante d’équilibre K associée à l’équation de cette réaction en fonction de pKA1 et pKA2.
- Montrer que l’expression de la concentration de NH+4(aq) et celle de CH3NH2(aq) dans le mélange réactionnel à l’équilibre s’écrit :
[CH3NH2(aq)]éq=[NH+4(aq)]éq=C2√K1+√K
- Montre que le pH du mélange réactionnel à l’équilibre s’écrit pH=12(pKA1+pKA2), puis calculer sa valeur
Données à 25°C :
pKA1(NH+4/NH3)=9,2pKA2(CH3NH+3/CH3NH2)=10,7


