
Physique et Chimie : 3ème Année Collège
Séance 6 (Tests de reconnaissance de quelques ions)
Professeur : Mr El GOUFIFA Jihad
Sommaire
I- Introduction
II- Principe de reconnaissance des ions
III- Couleur des ions
IV- Identification des ions chlorure
V- Identification des ions métalliques
5-1/ Identification des ions Cuivre II
5-2/ Identification des ions Fer II
5-3/ Identification des ions Fer III
5-4/ Identification des ions Zinc
5-5/ Identification des ions Aluminium
VI- Conclusion
VII- Exercices
7-1/ Exercice 1
7-2/ Exercice 2
7-3/ Exercice 3
7-4/ Exercice 4
I- Introduction
Quelques ions sont plus indispensables au développement des êtres vivants, plus précisément au corps humain et toute carence de ces ions peut conduire à des graves conséquences :une perte d'appétit, une, une chute de la tension artérielle, une fatigue anormale...
- Comment identifier les ions en solution aqueuse ?
II- Principe de reconnaissance des ions
Pour mettre en évidence la présence d’ions dans des solutions, on réalise des réactions de précipitation.
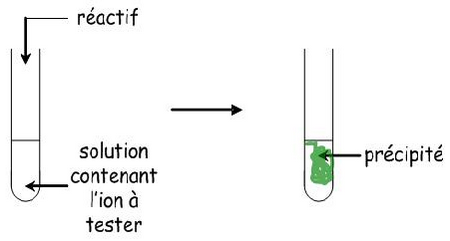
Pour réaliser les tests on doit suivre les étapes suivantes :
- On verse une petite quantité de solution contenant l’ion à tester dans un tube à essai.
- On rajoute ensuite quelques gouttes du réactif (solution détecteur) dans le tube à essai.
- On observe alors la couleur du précipité obtenu.
III- Couleur des ions
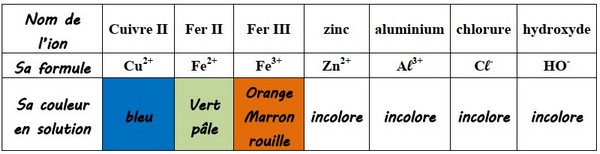
Certains ions colorent les solutions aqueuses, donnant ainsi une indication de leurs présences :

IV- Identification des ions chlorure
 |
 |
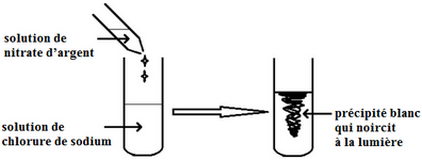
Lorsqu’on verse quelques gouttes de nitrate d’argent à une solution aqueuse contenant l’ion chlorure , Il se forme un précipité blanc qui noircit à la lumière : c’est le chlorure d’Argent de formule chimique .
L’équation de la réaction est :
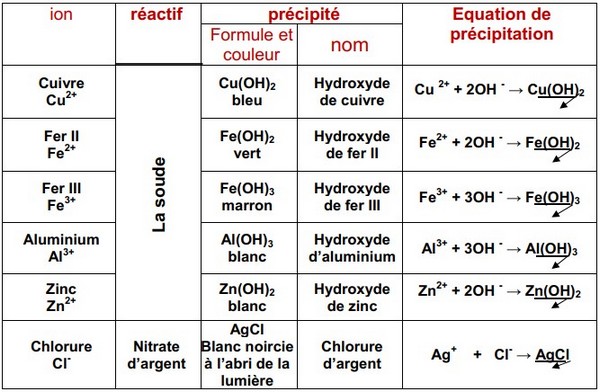
V- Identification des ions métalliques
5-1/ Identification des ions cuivre II
 |
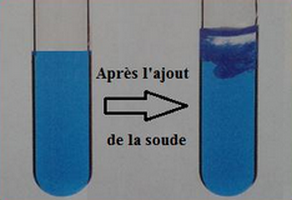 |
Lorsqu’on verse quelques gouttes de soude à une solution aqueuse contenant l’ion cuivre II , Il se forme un précipité bleu : c’est l’hydroxyde de cuivre II de formule chimique .
L’équation de la réaction est :
V- Identification des ions métalliques
5-2/ Identification des ions fer II
 |
 |
Lorsqu’on verse quelques gouttes de soude à une solution aqueuse contenant l’ion fer II , Il se forme un précipité vert : c’est l’hydroxyde de fer II de formule chimique .
L’équation de la réaction est :
V- Identification des ions métalliques
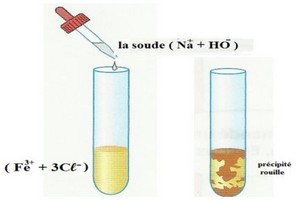
5-3/ Identification des ions fer III
 |
 |
Lorsqu’on verse quelques gouttes de soude à une solution aqueuse contenant l’ion fer III , Il se forme un précipité marron : c’est l’hydroxyde de fer III de formule chimique .
L’équation de la réaction est :
V- Identification des ions métalliques
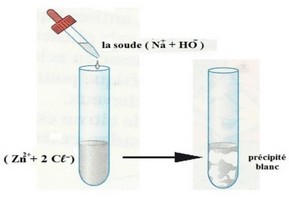
5-4/ Identification des ions Zinc
 |
 |
Lorsqu’on verse quelques gouttes de soude à une solution aqueuse contenant l’ion Zinc , Il se forme un précipité blanc : c’est l’hydroxyde de zinc de formule chimique .
L’équation de la réaction est :
V- Identification des ions métalliques
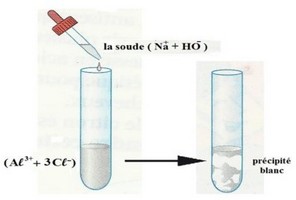
5-5/ Identification des ions Aluminium
 |
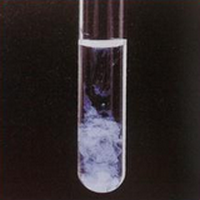 |
Lorsqu’on verse quelques gouttes de soude à une solution aqueuse contenant l’ion Aluminium , Il se forme un précipité blanc : c’est l’hydroxyde d’aluminium de formule chimique .
L’équation de la réaction est :
VI- Conclusion
VII- Exercices
7-1/ Exercice 1
Relier par une flèche :
|
----------- |
|
----------- |
|
VII- Exercices
7-2/ Exercice 2
Le sulfate de fer vendu dans le commerce se présente sous la forme d’une poudre verte.
Il est utilisé comme anti mousse par épandage sur les gazons.
Après avoir ouvert un paquet neuf, Sara dissout un peu de poudre dans de l’eau.
Elle prélève une partie de la solution et y ajoute quelques gouttes de soude (hydroxyde de sodium).
Elle observe un précipité vert.
- Quel ion a-t-elle mis en évidence ?
- Quelle est sa formule ?
- Écrire l’équation de précipitation.
Elle laisse la solution à l’air libre et revient quelques jours plus tard.
Elle prélève à nouveau un peu de solution et y ajoute quelques gouttes de soude.
Elle observe alors un précipité de couleur rouille.
- Quel ion a-t-elle mis en évidence lors du 2ème ajout de soude ?
- Quelle est la formule du précipité couleur rouille ?
- Écrire l’équation de précipitation.
VII- Exercices
7-3/ Exercice 3
Nous avons une solution contenant deux ions pour les identifier.
A- On ajoute à une quantité de cette solution un peu de solution de soude et on observe la formation d’un précipité vert.
- Donnez le nom de ce précipité vert, puis écrivez sa formule.
- Écrivez le symbole de l'ion détecté.
- Écrivez l'équation de cette réaction de précipitation.
B- On ajoute à l'autre quantité de solution des gouttes de solution de nitrate d'argent , on observe la formation d’un précipité blanc qui noircit sous l'influence de la lumière.
- Donner le nom et la formule du précipité blanc.
- Écrivez le symbole et le nom de l'ion détecté.
- Écrivez l'équation de cette réaction de précipitation.
- À partir des deux expériences précédentes, donnez le nom et la formule de la solution.
VII- Exercices
7-4/ Exercice 4
Pour détecter les ions et , nous ajoutons une solution aqueuse A aux solutions aqueuses suivantes :
- S1 : solution de sulfate de fer II
- S2 : solution de chlore de fer III
- Donner le nom de la solution A et écrire sa formule .
- Écrire la formule ionique des solutions aqueuses S1 et S2 .
- Donner la couleur de chaque solution .
- Donner le nom du précipité formé dans chaque cas après l'ajout de la solution A .
- Écrire l'équation de précipitation dans chaque cas.


