
Physique et Chimie : 2ème Année Bac
Séance 8 (Transformations chimiques s'effectuant dans les 2 sens)
Professeur : Mr El GOUFIFA Jihad
Sommaire
I- Réactions Acido-Basiques
1-1/ Définition de Bronsted
1-2/ Notion de couple acide-base
1-3/ Exemples de quelques couples acide-base
1-4/ Réactions acido-basiques
II- Définition du pH d’une solution aqueuse
2-1/ Définition du pH
2-2/ Mesure du pH
III- Avancement d'une réaction chimique
3-1/ Avancement final et avancement maximal
3-2/ Taux d’avancement final d’une réaction chimique
3-3/ Détermination expérimentale du taux d’avancement final (Exercice)
IV- Équilibre chimique d’un système chimique
4-1/ Notion d'équilibre dynamique
4-2/ Interprétation microscopique de l'état d'équilibre d'un système
V- Exercices
5-1/ Exercice 1
5-2/ Exercice 2
5-3/ Exercice 3
5-4/ Exercice 4
I- Réactions Acido-Basiques
1-1/ Définition de Bronsted
On appelle acide de Bronsted toute espèce chimique capable de céder un proton pendant une transformation chimique.
On appelle base de Bronsted toute espèce chimique capable de capter un proton pendant une transformation chimique.
1-2/ Notion de couple acide-base
Un couple Acide/Base (noté A/B) est constitué d’um acide A et de sa base conjuguée B qui sont généralement liés par la demi-équation :
Example
L'acide et sa base conjuguée sont liés par la demi-équation :
Le couple acide-base correspondant est :
I- Réactions Acido-Basiques
1-3/ Exemples de quelques couples acide-base
On donne dans le tableau suivant l’exemple de quelques couples acide-base:
|
Couple acide/base |
Acide |
Base conjuguée |
Demi-équation de réaction |
I- Réactions Acido-Basiques
1-4/ Réactions acido-basiques
Au cours d’une réaction acido-basique, il y’a échange d'un proton entre deux couples acide-base : et .
L'équation de la réaction entre l'acide du 1er couple et la base du 2ème couple s'écrit :
II- Définition du pH d’une solution aqueuse
2-1/ Définition du pH
Les propriétés acido-basique d'une solution aqueuse dépendent de la concentration des ions oxonium liée au pH de la solution par la relation suivante :
- Le pH est une grandeur sans unité.
- est exprimée en mol/L dans la relation de pH.
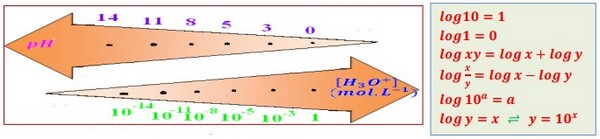
II- Définition du pH d’une solution aqueuse
2-2/ Mesure du pH
On peut avoir une indication de la valeur du pH en utilisant un papier pH qui prend une couleur plus ou moins rougeâtre selon l’acidité de la solution :

Pour mesurer le pH d'une solution de façon précise on utilise le pH-mètre qui se compose d'une sonde de mesure reliée à un voltmètre électronique gradué en unité de pH :
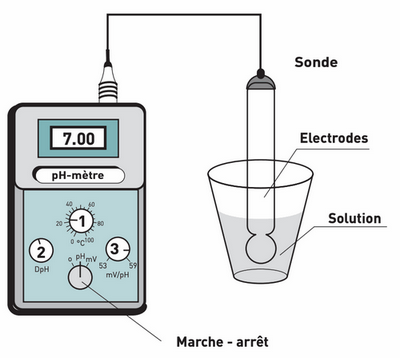
On doit étalonner le pH-mètre avant toute mesure.
III- Avancement d'une réaction chimique
3-1/ Avancement final et avancement maximal
L'avancement d'une réaction est la quantité de matière des réactifs qui disparaît ou des produits qui se forment selon les coefficients stœchiométriques.
L'avancement maximal est l'avancement qui correspond à la disparition du réactif limitant.
L'avancement final est la valeur de l'avancement qui correspond à l'état final d'une réaction limitée.
III- Avancement d'une réaction chimique
3-2/ Taux d’avancement final d’une réaction chimique
Le taux d'avancement final d'une réaction chimique est le quotient de l'avancement final par l'avancement maximal :
Le taux d'avancement est une grandeur sans unité.
- Si donc la réaction est totale.
- Si donc la réaction est limitée.
III- Avancement d'une réaction chimique
3-3/ Détermination expérimentale du taux d’avancement final (Exercice)
On introduit dans un bécher un volume d'eau distillée et on lui ajoute un volume d'une solution d'acide éthanoïque pure.
On mesure de le pH du mélange à l'aide d'un pH mètre et on obtient :
La réaction de l'acide éthanoïque avec l'eau s'écrit:
La densité de l'acide éthanoïque :
La masse volumique de l'eau :
La masse molaire de la molécule d'acide éthanoïque:
- Déterminer la quantité de matière initiale de l'acide éthanoïque.
- Dresser le tableau d'avancement de la réaction puis déterminer la valeur de l'avancement maximal.
- Déterminer la valeur de l'avancement final. Quelle est votre conclusion?
- Calculer le taux d'avancement final de la réaction.
IV- Équilibre chimique d’un système chimique
4-1/ Notion d'équilibre dynamique
Les ions éthanoate réagissent avec les ions oxoniums et cette réaction est aussi une réaction limitée.
C'est la réaction inverse de celle de l'acide éthanoïque avec l'eau.
Ces deux réactions se produisent en même temps et conduisent à un équilibre chimique qu'on symbolise par deux flèches:
Lorsque l'équilibre chimique est atteint, les quantités de matière des réactifs et des produits ne varient pas et le système n'évolue plus.
C'est ce qu'on appelle : état d'équilibre dynamique.
On constate ceci à partir du tableau d'avancement:
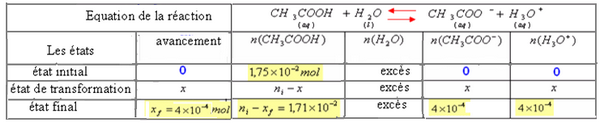
Lorsque l'équilibre dynamique est atteint la réaction apparait comme s'elle n'évolue plus.
IV- Équilibre chimique d’un système chimique
4-2/ Interprétation microscopique de l'état d'équilibre d'un système
On considère le système chimique:
A l'état initial le système contient les espèces chimiques A et B, la réaction se produit dans le sens (1) avec la vitesse .
Au cours du temps l'avancement augmente , par conséquence :
- Les quantités des espèces A et B ainsi que les chocs entre elles diminuent donc diminution de .
- Les espèces C et D apparaissent et la réaction se produit dans le sens (2) avec la vitesse , leur quantité ainsi que les chocs entre elles augmentent donc augmentation de .
Lorsque les deux vitesses et s'égalisent, le système n'évolue plus : C'est l'état d'équilibre dynamique.
Au niveau macroscopique le système ne semble pas évoluer

V- Exercices
5-1/ Exercice 1
Dans une fiole jaugée de volume , on introduit une masse d’acide éthanoïque , puis on complète cette fiole avec de l’eau distillée jusqu’au trait de jauge et on l’homogénéise.
On obtient une solution d’acide éthanoïque de concentration molaire .
On a
- Calculer la masse .
- Écrire l’équation de la réaction associée à la transformation de l’acide éthanoïque en présence d’eau.
- Construire le tableau d’avancement, en fonction de , et ( l’avancement à l’état d’équilibre).
- Exprimer le taux d’avancement final en fonction de la concentration en ions oxonium à l’équilibre et .
La mesure de la conductivité de la solution donne à 25°C.
- Exprimer la conductivité de la solution d’acide éthanoïque à l’état d’équilibre en fonction des conductivités molaires ioniques des ions présents et de la concentration en ions oxonium à l’équilibre .
- Calculer le pH de la solution.
- Calculer le taux d’avancement de la réaction.
On réalise la même étude, en utilisant une solution d’acide éthanoïque de concentration
La mesure de la conductivité de la solution donne à 25°C.
- Calculer le taux d’avancement de la réaction.
- En déduire l’influence de la concentration de la solution sur le taux d’avancement.
Conductivités molaires ioniques à conditions de l’expérience :
V- Exercices
5-2/ Exercice 2
On dissout une masse m=8,0g de nitrate d’ammonium dans l’eau.
Le sel (solide) de nitrate d’ammonium se dissout totalement, on obtient ainsi une solution A de volume V = 1,0 L.
Le pH de cette solution est pH = 5,1.
- Écrire l’équation de la dissolution de dans l’eau.
- Écrire l’équation de la réaction acido-basique notée (1) entre les couples et
- Dresser le tableau d’avancement de la réaction acido-basique et calculer le taux d’avancement final.
On augmente le volume de la solution A d’un facteur 3 en complétant avec de l’eau distillée.
On mesure la nouvelle valeur du pH et on trouve pH = 5,3.
- Quel est le volume final de la solution obtenue ?
- Calculer le nouveau taux d’avancement final.
- La réaction acido-basique est-elle totale ?
- Quel est l’effet de l’ajout de l’eau sur l’équilibre chimique (1) ?
V- Exercices
5-3/ Exercice 3
Un volume d’une solution aqueuse a été obtenu en apportant d’acide méthanoïque et d’éthanoate de sodium .
Dans l’état d’équilibre à , sa conductivité vaut .
- Écrire l’équation de la réaction et établir son tableau d’avancement.
- Exprimer la conductivité en fonction de l’avancement dans l’état d’équilibre. En déduire la valeur .
- Déterminer, à l’état d’équilibre, les concentrations molaires effectives des espèces chimiques participant à la réaction.
- Calculer la valeur du taux d’avancement final , conclure
Conductivités molaires ioniques à :
V- Exercices
5-4/ Exercice 4
L’acide éthanoïque (acétique) réagit de façon limitée avec l’eau, l’équation de la réaction s’écrit :
- Donner la définition d’un acide selon Bronsted.
- Dans l’équation ci-dessus, identifier les deux couples acides/base mis en jeu.
- Exprimer la constante d’équilibre K associée à l’équation de cet équilibre chimique.
Une solution d’acide éthanoïque, de concentration molaire initiale et de volume a un pH de 3,7 à 25°C.
- Déterminer la quantité de matière initiale de l’acide éthanoïque .
- Dresser le tableau d’avancement ,puis calculer l’avancement maximale.
- Déduire, de la mesure du pH, la concentration molaire finale des ions oxonium. Calculer l’avancement
final .
- Donner l’expression du taux d’avancement final , montrer qu’il a pour valeur . La transformation est-elle totale ?
- Calculer la concentration molaire finale en ions éthanoate .
- Calculer la valeur de la concentration molaire finale effective de l’acide éthanoïque .


