
Physique et Chimie : 3ème Année Collège
Séance 3 (Oxydation des métaux dans l'air)
Professeur : Mr El GOUFIFA Jihad
Sommaire
I- Introduction
II- Oxydation du fer dans l’air
2-1/ Protocole expérimental 1
2-2/ Protocole expérimental 2
2-3/ Conclusion
2-4/ Protection de fer contre la corrosion
III- Oxydation de l’aluminium dans l’air
3-1/ Protocole expérimental 1 (Oxydation à froid)
3-2/ Protocole expérimental 2 (Oxydation à chaud)
3-3/ Conclusion
IV- Conclusion
V- Exercices
5-1/ Exercice 1
5-2/ Exercice 2
5-3/ Exercice 3
5-4/ Exercice 4
I- Introduction
Les carrosseries et les portes en fer rouillent plus dans les zones côtières que dans les zones désertiques et sèches, les carrosseries des navires rouillent aussi plus que les navires hauturiers.
- Que se passe-t-il lorsque du fer est abandonné dans l'air humide ?
- Quels sont les facteurs qui favorisent l'attaque du fer dans l'air ?
- Comment protéger le fer contre la corrosion ?
- Que se passe-t-il lorsqu'une lame d'aluminium est abandonnée dans l'air ?
II- Oxydation du fer dans l’air
2-1/ Protocole expérimental 1
Expérience 1
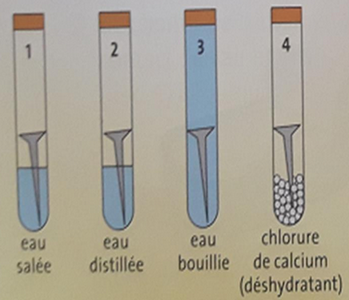
On introduit un clou en fer dans chacun des 4 tubes à essai suivants :
- Tube A : L’air et l’eau salée.
- Tube B : L’air et l’eau distillée.
- Tube C : l’eau bouillie.
- Tube D : le chlorure de calcium (déshydratant).
 |
 |
| Début de l'expérience | Quelques jours plus tard |
Observation 1
Quelques jours plus tard:
- Des traces de rouille apparaissent dans les tubes 1 et 2.
- La quantité de rouille est plus abondante dans le tube 1 que dans le tube 2.
- Les clous des tubes 3 et 4 ne sont pas rouillés.
II- Oxydation du fer dans l’air
2-2/ Protocole expérimental 2
Expérience 2
De la paille de fer est introduite dans une éprouvette humidifiée sur une cuve à eau.

Observation 2
Quelques jours plus tard:
- La paille de fer est rouillée.
- L'eau monte et occupe du volume de l'éprouvette à gaz.
C'est le dioxygène de l'air qui intervient dans la formation de la rouille.
L'eau occupe le volume libéré par le dioxygène.
II- Oxydation du fer dans l’air
2-3/ Conclusion
La formation de rouille n’est possible que si le fer est en contact avec de l’air et de l’eau ou plus simplement avec de l’air humide.
De plus, la présence de certaines substances (par exemple le sel) accélère la formation de le rouille.
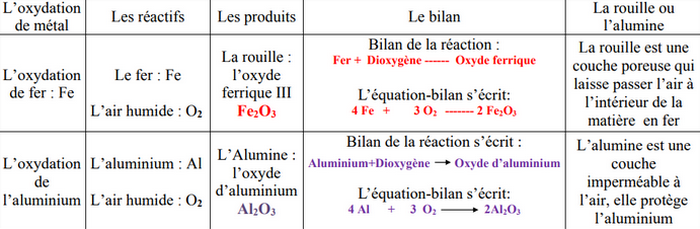
La rouille est le produit d’une corrosion, c’est-à-dire une oxydation à froid, elle est essentiellement constituée d’oxyde ferrique de formule , sa formation se fait selon une réaction chimique lente.
L’équation de cette oxydation s'écrit :
II- Oxydation du fer dans l’air
2-4/ Protection de fer contre la corrosion
La rouille est une couche poreuse cette dernière laisse passer l’eau et l’air qui peuvent continuer à réagir avec le fer en profondeur jusqu'à la disparition totale du fer.
Ce phénomène est appelé la corrosion..
Pour protéger le fer contre la rouille on peut le recouvrir d’une couche imperméable non poreuse comme :
- La peinture (carrosseries).
- L’étain (métal blanc).
- La matière plastique.
- Le vernis.
- L’huile ou la graisse.
- Le zinc (galvanisation).
- D'autres métaux (nickel – chrome …).
III- Oxydation de l’aluminium dans l’air
3-1/ Protocole expérimental 1 (Oxydation à froid)
Expérience 1
Exposer la plaque en aluminium à l’air humide, laisser pendant quelques jours, puis observer.

Observation 1
Nous observons l’apparition d’une couche gris foncé sur la plaque, indiquant que la réaction de l’aluminium avec la dioxygène permet la formation d’alumine ou d’oxyde d’aluminium.
III- Oxydation de l’aluminium dans l’air
3-2/ Protocole expérimental 2 (Oxydation à chaud)
Expérience 2
Chauffer un fil d’aluminium et observer.

Observation 2
Un fil d'aluminium chauffé dans une flamme fond mais ne coule pas.
La partie chauffée se recouvre d'une pellicule blanche d'oxyde d'aluminium ou alumine, qui le protège d'une oxydation en profondeur.
L'aluminium fondu (température de fusion : ) reste prisonnier dans le sac d'alumine qui ne peut fondre qu'à la température de , nettement supérieure à celle de la flamme.
III- Oxydation de l’aluminium dans l’air
3-3/ Conclusion
À froid ou à chaud, l'aluminium réagit avec le dioxygène de l'air en produisant l'oxyde d'aluminium appelé aussi alumine de formule chimique Al2O3.
Équation-bilan de la réaction :
La couche d’oxyde d’aluminium qui se forme est imperméable à l’air et protège le métal et garde sa rigidité pendant longtemps.
IV- Conclusion
V- Exercices
5-1/ Exercice 1
Répondre par vrai ou faux :
- Le fer rouille plus rapidement dans l’eau de mer que dans l’eau de rivière : ___________
- L’alumine est le produit d’oxydation du fer dans le dioxygène. Elle protège le métal : ___________
- L’eau est nécessaire pour former la rouille : ___________
- La formation de la rouille se fait en présence de l’air sec : ___________
- L’aluminium s’oxyde jusqu’à sa destruction dans l’air humide : ___________
- L’acier est un alliage qui résiste à la corrosion : ___________
V- Exercices
5-2/ Exercice 2
Compléter les phrases suivantes :
Le fer s’oxyde lentement à l’air _______________ pour donner de la _______________ qui est un oxyde _______________ . Cette transformation chimique nécessite le fer, le dioxygène et de l’ _______________ .
La _______________ du fer contre la corrosion se fait en utilisant la _______________ ou le _______________ .
L’alumine est une couche qui n’est pas _______________ , mais étanche à l’air. Elle empêche l’air d’être au
contact de l’ _______________ et le protège contre la _______________ . L’aluminium ne peut donc
pas s’ _______________ en profondeur.
V- Exercices
5-3/ Exercice 3
Dans les villes côtières le fer est plus vite attaqué en comparaison avec le fer dans les villes qui sont loin de la mer.
- Donner une explication à cette constatation.
- Citer deux méthodes pour protéger le fer contre l’action de l’air.
La carrosserie de voiture est faite en fer en général. Certains constructeurs d’automobiles utilisent l’aluminium.
- Expliquer la nécessité de peindre une voiture dont la carrosserie faites en fer.
- Citer deux avantages pour construire la carrosserie d’une voiture en aluminium.
L’un des alliages de l’aluminium est appelé Alpax avec la composition (environ) 13% de silicium et 87% d’aluminium.
- Qu’est-ce qu’un alliage ?
- La carcasse d’une voiture en Alpax pèse une tonne. Calculer la masse d’aluminium dans l’objet en Kg.
V- Exercices
5-4/ Exercice 4
Pour déterminer le constituant de l’air qui provoque l’oxydation du fer on réalise les deux expériences schématises ci-dessous :

La laine de fer introduite dans une éprouvette humidifiée retournée sur une cuve à eau.
Au bout de quelques jours, on observe :
Expérience 1 :
- La laine de fer est partiellement rouillée.
- L’eau est montée partiellement dans l’éprouvette.
Expérience 2 :
- La laine de fer est complètement rouillée.
- L’eau a occupé toute l’éprouvette.
- En observant le schéma (Expérience 1) comparer le volume qui a été occupé par l’eau à celui de l’éprouvette. Déduire la proportion de ce volume.
- En observant le schéma (Expérience 2), expliquer pourquoi l’eau a occupé toute l’éprouvette.
- Quelle est la proportion du volume du dioxygène dans l’air ?
- Expliquer comment peut-on déduire des deux expériences (1) et (2) que le constituant de l’air qui a provoqué la rouille de la laine de fer est le dioxygène.
- Sachant que la rouille de fer est constituée essentiellement de l’oxyde de fer , écrire l’équation chimique équilibrée de la réaction qui donne ce produit.


