
Physique et Chimie : Tronc Commun
Séance 9 (Le modèle de l'atome)
Professeur : Mr EL GOUFIFA Jihad
Sommaire
I- Évolution historique du modèle de l'atome
II– Structure de l’atome
2-1/ Modélisation de l’atome
2-2/ Constituants de l’atome
2-3/ Symbole du noyau atomique
2-4/ Neutralité électrique de l'atome
2-5/ Masse de l’atome
2-6/ Dimension de l’atome
III- L’élément chimique
3-1/ Définition
3-2/ Les isotopes
3-3/ Les ions monoatomiques
3-4/ L’élément chimique
IV- Répartition des électrons d’un atome
4-1/ Les couches électroniques
4-2/ Les règles de remplissage des couches électroniques
4-3/ La structure électronique de l’atome
V- Exercices
5-1/ Exercice 1
5-2/ Exercice 2
5-3/ Exercice 3
5-4/ Exercice 4
I- Évolution historique du modèle de l'atome

II– Structure de l’atome
2-1/ Modélisation de l’atome
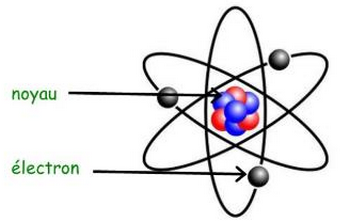
Le modèle de l’atome est constitué d’un noyau autour duquel gravitent des électrons.
Les électrons tournent autour du noyau dans une zone sphérique délimitant la taille de l’atome appelée nuage électronique.
Le noyau de l’atome est constitué de particules appelés nucléons, les neutrons et les protons.
II– Structure de l’atome
2-2/ Constituants de l’atome
Le noyau
Il est constitué de particules élémentaires appelées: nucléons, qui sont de deux sortes : les protons et les neutrons.
Le proton est une particule de charge: , et de masse .
Le neutron, particule neutre électriquement, a une masse voisine de celle du proton : .
On appelle le nombre de nucléons contenus dans un noyau : nombre de masse de symbole .
Le nombre de protons du noyau s’appelle nombre de charge ou numéro atomique, et se note .
II– Structure de l’atome
2-2/ Constituants de l’atome
Les électrons
Un électron est beaucoup plus léger qu’un nucléon. Sa masse est .
Sa charge électrique est l’opposé de celle du proton : .
La masse du proton est 1836 fois la masse de l’électron .
II– Structure de l’atome
2-3/ Symbole du noyau atomique
On appelle le nombre de nucléons contenus dans un noyau : nombre de masse de symbole .
Le nombre de protons du noyau s’appelle nombre de charge ou numéro atomique, et se note .
On représente le noyau d’un atome ou l’atome même par le symbole suivant :
- A : nombre de masse
- Z : numéro atomique
Exemple
| L’atome | Symbole | Numéro atomique Z | Nombre de nucléons A | Nombre de neutrons N |
| Hydrogène | 1 | 1 | 0 | |
| Oxygène | 8 | 16 | 8 | |
| Chlore | 17 | 35 | 18 |
II– Structure de l’atome
2-4/ Neutralité électrique de l'atome
Un atome étant électriquement neutre, il possède autant de protons que d’électrons.
- Charge de protons : .
- Charge d’électrons : .
- Charge de l’atome : .
La charge électrique totale de l'atome est nulle.
II– Structure de l’atome
2-5/ Masse de l’atome
La masse de l’atome est la somme de la masse de ses différents constituants :
Si on néglige la masse des électrons devant celle des protons, alors la masse approchée de l’atome est égale à :
La masse de l’atome est concentrée dans son noyau.
II– Structure de l’atome
2-6/ Dimension de l’atome
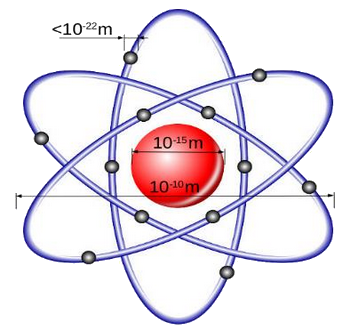
Le noyau est assimilé à une boule dense constituée des nucléons et dont son rayon est de l'ordre de .
L'atome est assimilé à une sphère dont son rayon est voisin de celui des orbites décrites par les électrons en mouvement, est de l'ordre de .
Le rapport du rayon de l'atome au rayon du noyau est :
L’atome est essentiellement constitué de vide, ce qui explique sa structure lacunaire.
III- L’élément chimique
3-1/ Définition
On donne le nom d'élément chimique à l'ensemble des entités chimiques définies par le même numéro atomique Z.
Exemple :
- Z=6 Élément de carbone.
- Z=8 Élément d’oxygène.
III- L’élément chimique
3-2/ Les isotopes
On appelle atomes isotopes les ensembles d'atomes caractérisés par le même numéro atomique Z et des nombres de nucléons A différents.
Ce sont donc des ensembles d'atomes qui ne diffèrent que par le nombre de leurs neutrons.
L'abondance naturelle est le pourcentage en nombre d'atomes de chacun des isotopes tel que trouvé dans la nature.

III- L’élément chimique
3-3/ Les ions monoatomiques
Un ion monoatomique est un atome qui a perdu ou gagné un (ou plusieurs) électron(s).
L’ion positif est appelé cation et L’ion négatif est appelé anion.
Exemples :
- L’ion cuivre II : (Anion)
- L’ion chlorure : (Cation).
III- L’élément chimique
3-4/ Conservation de l’élément chimique
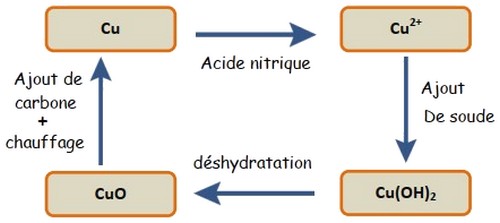
Transformation 1 : l’action de l’acide nitrique sur le métal cuivre Ion de cuivre II .
Transformation 2 : réaction entre les ions de cuivre II et la soude hydroxyde de cuivre
II .
Transformation 3 : déshydratation par chauffage d’hydroxyde de cuivre II monoxyde de cuivre .
Transformation 4 : réaction de carbone avec monoxyde de cuivre métal cuivre .
Conclusion
Dans toutes les transformations, on observe une évolution du cuivre en différentes formes.
On dit qu’il y a conservation de l'élément chimique lors de transformations chimiques
IV- Répartition des électrons d’un atome
4-1/ Les couches électroniques
Les électrons sont en mouvement autour du noyau : on parle du « cortège électronique » du noyau.
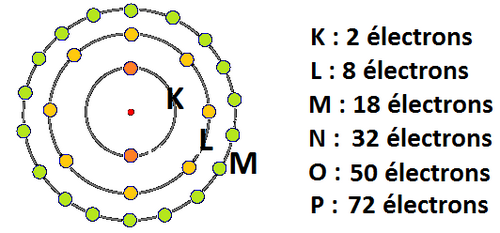
Les électrons d’un atome se répartissent dans des couches électroniques autour du noyau.
Chaque couche est représentée par une lettre K, L, M pour les atomes qui ont .
La dernière couche occupée s’appelle la couche externe. Les électrons qui l’occupent sont appelés les électrons périphériques de l’atome.
IV- Répartition des électrons d’un atome
4-2/ Les règles de remplissage des couches électroniques
Première règle
Une couche électronique ne peut contenir qu'un nombre limité d'électrons.
- La couche K (première couche) peut contenir un maximum de 2 électrons.
- La couche L (deuxième couche) peut contenir un maximum de 8 électrons.
- La couche M (troisième couche) peut contenir un maximum de 8 électrons
(seulement pour les éléments tels que ).
Deuxième règle
Le remplissage des couches électroniques s'effectue en commençant par la couche K.
Lorsqu'elle est saturée on remplit la couche L et ainsi de suite.
Lorsqu'une couche est pleine on dit qu'elle est saturée.
IV- Répartition des électrons d’un atome
4-3/ La structure électronique de l’atome
La structure électronique est composée des lettres correspondant aux couches K,L,M.
Les lettres sont écrites entre parenthèse et on indique le nombre d’électrons qu’elles contiennent en exposant.
Exemples :
- Structure électronique de l’atome de carbone :
- Structure électronique de l’atome de soufre :
V- Exercices
5-1/ Exercice 1
Le noyau d’un atome porte une charge électrique .
Le nombre de nucléons A de cet atome est le double du nombre de protons Z.
- Déterminer le numéro atomique Z de cet atome.
- Déterminer le nombre de masse A.
- Déterminer la masse du noyau.
- Donner la représentation symbolique de cet atome, sachant que son symbole chimique est S.
V- Exercices
5-2/ Exercice 2
Le rayon atomique de l’atome de bismuth de symbole chimique Bi est .
La charge du noyau atomique est .
La masse volumique de l’atome de bismuth est .
- Déterminer le volume de l’atome de bismuth, si l’on considère l’atome comme une sphère :
- Déterminer le numéro atomique Z
- Donner la représentation symbolique de l’atome de bismuth
- Déterminer la composition en neutrons, en protons, et en électrons de cet atome
V- Exercices
5-3/ Exercice 3
Un atome inconnu possède12 neutrons et deux électrons sur sa couche externe M.
- Déterminer la configuration électronique de cet atome.
- Déterminer le numéro atomique Z de cet atome.
- Déterminer la charge électrique du noyau.
- Donner la représentation symbolique de cet atome sachant que son symbole chimique est Mg.
L’ion formé par cet atome résulte de la perte de deux électrons de la couche externe.
- Donner la structure électronique de cet ion.
- Déterminer la charge électrique portée par cet ion. S’agit-il d’un cation ou d’un anion ?
- Écrire la formule chimique de cet ion.
V- Exercices
5-4/ Exercice 4
L’élément chimique de numéro atomique 19 est le potassium, le noyau de cet atome contient 20 neutrons.
- Quel est le nombre de nucléons de cet atome ?
- Combien d’électrons possède-t-il ?
- Donner sa représentation symbolique.
- Calculer la masse mAtome d’un atome de potassium.
- Quel est approximativement le nombre d’atomes de potassium dans un échantillon de masse ?
L’ion potassium possède 18 électrons.
- Quel est son symbole ?
- S’agit-il d’un anion ou d’un cation ?


