
Physique et Chimie : Tronc Commun
Séance 8 (Synthèse des espèces chimiques)
Professeur : Mr EL GOUFIFA Jihad
Sommaire
I- Nécessité de la chimie de synthèse
II- Synthèse d’un espèce chimique
2-1/ Définition
2-2/ Synthèse de l’acétate de linalyle
III- Séparation est identification du produit
3-1/ Élimination de l’excès d’anhydride acétique
3-2/ Extraction de l’acétate de linalyle
3-3/ Identification de l’espèce chimique
IV- Exercices
4-1/ Exercice 1
4-2/ Exercice 2
4-3/ Exercice 3
4-4/ Exercice 4
I- Nécessité de la chimie de synthèse
La synthèse pour satisfaire la demande
L’odeur, la couleur, la saveur d’un produit naturel sont dues à une ou plusieurs espèces chimiques.
Lorsque la demande de ce produit est énorme, il est impératif de le synthétiser afin de ne pas épuiser les ressources naturelles.
- Ex : la vanilline de synthèse, les engrais chimiques, le caoutchouc synthétique
La synthèse pour préserver les ressources naturelles
Pour ne pas voir disparaître certains produits naturels, des produits de synthèse sont crées.
- Ex : les éponges synthétiques remplacent les éponges naturelles, les boules de billard en ivoire ont été remplacées par des boules en celluloïd.
La synthèse pour créer des matériaux plus performants
Des produits nouveaux aux propriétés physiques et mécaniques supérieures, remplacent des produits naturels traditionnellement utilisés.
- Ex : les chaussures de ski en matériaux de synthèse, les fibres de carbone
II- Synthèse d’un espèce chimique
2-1/ Définition
Réaliser une synthèse d’une espèce chimique, c’est la préparer à partir d’autres espèces chimiques grâce à une transformation chimique.
Les espèces chimiques nécessaire à la synthèse sont appelées les réactifs de la synthèse.
Les espèces chimiques obtenues sont appelées les produits de la synthèse.
II- Synthèse d’un espèce chimique
2-2/ Synthèse de l’acétate de linalyle
Principe
On fait réagir un alcool de linalol sur de l’anhydride acétique.
On obtient de l’acétique de linalyle et de l’acide acétique.
La réaction chimique peut s’écrire de la forme :
linalol + anhydride acétique acétate de linalyle + acide acétique
II- Synthèse d’un espèce chimique
2-2/ Synthèse de l’acétate de linalyle
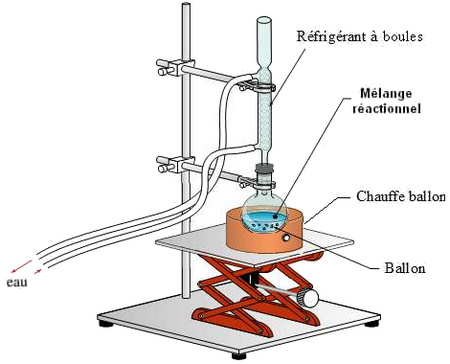
Mode opératoire
À l’aide d’une éprouvette de 50mL, mesurer un volume de 5mL de linalol.
Dans un ballon de 250mL, introduire 7mL d’anhydride acétique) puis les 5 mL de linalol.
Ajouter 4 ou 5 grains de pierre ponce.
Porter le mélange à ébullition douce, ne pas oublier de faire circuler l’eau froide dans le réfrigérant, on pratique ainsi un chauffage à reflux pendant environ 40 minutes.
Arrêter alors le chauffage, isoler le ballon du chauffe ballon et laisser refroidir.
Lorsque la synthèse est terminée, il faut séparer et purifier le produit.
II- Synthèse d’un espèce chimique
2-2/ Synthèse de l’acétate de linalyle
Remarques
L’intérêt de la pierre ponce est de régulier l’ébullition.
L’intérêt de chauffer le milieu réactionnel est d’accélérer la réaction chimique entre les deux réactifs.
Le rôle de chauffage à reflux permet d’augmenter la vitesse de la réaction et d’éviter la perte des réactifs est des produits.
Le rôle de réfrigérant est de condenser les vapeurs qui s’échappent du mélange.
III- Séparation est identification du produit
3-1/ Élimination de l’excès d’anhydride acétique
Pour d’éliminer l’anhydride acétique qui n’aurait pas complètement réagit avec le linalol, on ajoute de l’eau, l’anhydride acétique restant se transforme alors en acide acétique.
III- Séparation est identification du produit
3-2/ Extraction de l’acétate de linalyle
Il s’agit d’éliminer l’acide acétique qui resterait en le faisant réagir avec de l’hydrogénocarbonate de sodium.
Il se forme du dioxyde de carbone et un autre produit très soluble dans l’eau.
III- Séparation est identification du produit
3-3/ Identification de l’espèce chimique
Après l’extraction du produit, il faut le caractériser grâce à ses propriétés physiques :
- Sa température de fusion ou d’ébullition.
- Sa solubilité.
- Sa densité ou sa masse volumique.
Une chromatographie sur couche mince peut être réalisée pour vérifier d’une part si le produit obtenu est celui désiré (ceci se fait par comparaison avec le même produit de référence), et d’autre part pour vérifier la pureté du produit obtenu.

IV- Exercices
4-1/ Exercice 1
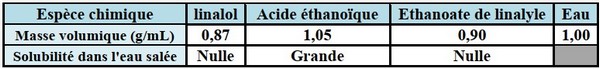
Pour synthétiser l’éthanoate de linalyle, principal constituant de l’essence de lavande, on suit le Protocole expérimental suivant:
- Dans un ballon de , verser de linalol, d’acide éthanoïque et d’acide sulfurique.
- Chauffer à reflux pendant une heure.
- Après refroidissement du ballon, verser le contenu dans une ampoule à décanter.
- Ajouter l’eau salée et agiter vigoureusement.
- Laisser décanter, puis éliminer la phase aqueuse.
Afin de vérifier l’identité du produit obtenu, on réalise une chromatographie.
 |
 |
- Quelle est l’utilité du chauffage à reflux ?
- Quelle masse d’acide éthanoïque a-t-on utilisée ? Quelle masse de linalol a-ton utilisée ?
- Le protocole fait intervenir une ampoule à décanter. Quelle est son utilité ?
- Indiquer sur le schéma ci-contre les positions de l’eau et de l’éthanoate de linalyle et Indiquer ce que représente chaque numéro de la légende du montage.
- Commenter le chromatogramme obtenu.
- A-t-on réalisé la synthèse de l’éthanoate de linalyle ? Si oui, le produit synthétisé est-il pur ? Justifier votre réponse.
Données :
- L : linalol pur.
- AL : éthanoate de linalyle pur.
- HE : huile essentielle de lavande.
- ALS : produit de synthèse.
IV- Exercices
4-2/ Exercice 2
L’acétate de menthyle est un ester qui amplifie la touche « florale » des eaux de lavande commerciales. On le prépare à partir d’acide acétique et de menthol.
Pour synthétiser cet ester, on introduit dans un ballon à fond rond de l’acide acétique, du menthol, quelques gouttes d’acide sulfurique concentré (très soluble dans l’eau) et de la pierre ponce. On adapte un réfrigérant à eau vertical sur le ballon. On chauffe à reflux pendant .
- Quel est l’état physique des composés indiqués dans le tableau à et à ?
- Faire un schéma annoté décrivant le chauffage à reflux.
- Qu’appelle-t-on synthèse en chimie ?
- Quel est le rôle du réfrigérant ? Préciser sur le schéma le sens de la circulation de l’eau dans le réfrigérant.
- Quel est le rôle de la pierre ponce ? Quel est celui du chauffage à reflux ?
Après refroidissement, on verse le contenu du ballon dans un bécher contenant de l’eau froide.
Il se forme deux phases non miscibles. L’une organique et l’autre aqueuse.
- Comment peut-on séparer ces deux phases ? Faire un schéma annoté du procédé utilisé : nommer la verrerie et positionner les deux phases.
On lave et sèche la phase organique.
- Qu’est-ce qui permet d’affirmer qu’elle contient l’ester ?

IV- Exercices
4-3/ Exercice 3
Voici le protocole permettant de réaliser la synthèse d’un savon :
Introduire, dans un ballon de 250 mL, 20 mL d’huile d’arachide, 10 mL de solution d’hydroxyde de sodium (soude) et 20 mL d’éthanol à 90°.
Adapter au ballon un système réfrigérant et porter le liquide à ébullition douce pendant 20min.

- Associez à chacune des lettres du schéma la légende qui convient parmi les suivantes :
chauffe-ballon - ballon - potence - tube réfrigérant - mélange réactionnel.
- Quel est le rôle de la circulation d’eau dans le tube réfrigérant ?
- Que signifie le mot réfrigérant ?
- Quels sont les réactifs utilisés pour la synthèse du savon ?
- Quel est le domaine de pH de la solution d’hydroxyde de sodium ?
IV- Exercices
4-4/ Exercice 4
L’acétate de 3-méthylbutyle est une espèce chimique qui possède une odeur caractéristique de banane.
On le prépare en deux étapes puis on le caractérise par chromatographie.
Étape 1 : Synthèse de l’espèce chimique
Dans un ballon, on introduit du 3-méthylbutan-1-ol (ou alcool isoamylique), de l’acide acétique, quelques gouttes d’acide sulfurique (catalyseur) et quelques grains de pierre ponce.
On chauffe le contenu du ballon à reflux pendant une demi-heure (30 min).
Étape 2 : Extraction de l’espèce chimique
On refroidit le ballon et on verse son contenu dans un bécher contenant de l’eau froide.
On introduit ensuite le mélange dans une ampoule à décanter et on écarte la phase aqueuse.
Étape 3 : Purification de la phase organique
La phase organique est recueillie dans un bécher puis lavée avec une solution saturée de chlorure de sodium.
De nouveau, la phase aqueuse est écartée par décantation.
Le liquide surnageant recueilli a une odeur caractéristique de banane.
Dans cette phase organique, on introduit environ une spatule de sulfate de magnésium anhydre (solide blanc).
Étape 4 : Chromatographie sur couche mince
On analyse par chromatographie ce liquide.
Pour cela on effectue trois dépôts :
- dépôt A : solution de 3-méthylbutan-1-ol (ou alcool isoamylique)
- dépôt B : le liquide obtenu après purification (3)
- dépôt C : solution d’acétate de 3-méthylbutyle (ou acétate d’isoamyle espèce chimique pure achetée dans le commerce).
- Faire le schéma annoté d’un montage à reflux avec réfrigérant à eau.
Sur le schéma annoté d’un montage à reflux avec réfrigérant à eau on trouvera le vocabulaire suivant : élévateur, chauffage, ballon, contenu du ballon, colonne réfrigérante, entrée et sortie d’eau pour le réfrigérant à eau.
- Quel est le rôle du condenseur ? et celle de la pierre ponce ? et celle de l’acide sulfurique ?
- Schématiser l’ampoule à décanter et indiquer les différentes phases et ce qu’elles contiennent. Justifier la réponse en utilisant pour cela le tableau des données.
- Pourquoi ajoute-t-on du chlorure de sodium ?
Dans une phase organique on introduit du sulfate de magnésium anhydre (solide blanc).
- Que signifie le terme « anhydre » ? Quel est le but de cette opération ?
- Décrire rapidement les opérations permettant de réaliser la chromatographie.
- Quel est le rôle joué par l’éluant dans une chromatographie ?
Voici le résultat de la chromatographie :

- Compléter le schéma. Identifier A et B et conclure en ce qui concerne l’espèce chimique obtenue après synthèse et extraction.
Données :



