
Physique et Chimie : 2ème Année Collège
Séance 5 (Les réactions chimiques)
Professeur : Mr El GOUFIFA Jihad
Sommaire
I- Transformation physique et transformation chimique
1-1/ Transformation physique
1-2/ Transformation chimique
II- Notion de réaction chimique
2-1/ Définition
2-2/ Exemple (Combustion du carbone)
III- Réaction entre le fer et le soufre
3-1/ Expérience
3-2/ Observation
3-3/ Conclusion
IV- Combustion du méthane
4-1/ Expérience
4-2/ Observation
4-3/ Conclusion
V- Conclusion
VI- Exercices
6-1/ Exercice 1
6-2/ Exercice 2
6-3/ Exercice 3
6-4/ Exercice 4
I- Transformation physique et transformation chimique
1-1/ Transformation physique
Une transformation physique est le passage d'un corps d'une forme physique à une autre, sans modification de la nature des molécules mises en jeu.
Exemple
Transformation physique de l'eau de l'état liquide à l'état gazeux:

1-2/ Transformation chimique
Une transformation chimique s'accompagne d'une modification des espèces chimiques présentes dans l'état initial.
Les atomes présents dans les molécules de départ sont redistribués afin de former de nouvelles molécules.
Exemple
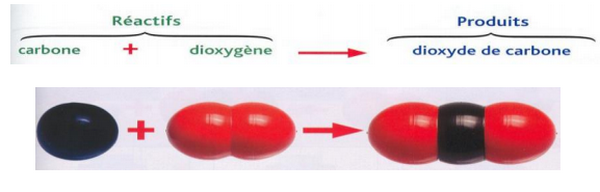
Combustion du carbone:
II- Notion de réaction chimique
2-1/ Définition
La réaction chimique est une transformation au cours de laquelle, des corps disparaissent et d’autres nouveaux corps apparaissent à la suite d’un réarrangement des atomes.
- Les corps qui disparaissent s’appellent Réactifs.
- Les corps qui apparaissent s’appellent Produits.
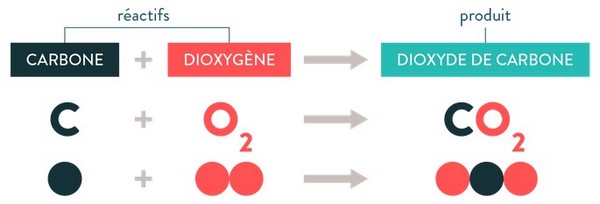
2-2/ Exemple (Combustion du carbone)
Lorsqu’on brûle du carbone (charbon de bois) dans le dioxygène, la réaction produit du dioxyde de carbone et de l’eau.
En chimie, on traduira cette phrase par :
III- Réaction entre le fer et le soufre
3-1/ Expérience
On brûle le mélange de limaille de fer et du soufre avec la flamme du bec Bunsen.

3-2/ Observation
L’incandescence se propage
On obtient un solide noir grisâtre poreux et friable, non attiré par un aimant.
La matière noirâtre n'est plus du fer, ni du soufre. C'est une nouvelle matière appelée sulfure de fer
3-3/ Conclusion
La réaction entre le fer et le soufre donne le sulfure de fer de formule FeS.
On écrit le bilan de cette réaction de la façon suivant :
IV- Combustion du méthane
4-1/ Expérience
On réalise le montage suivant:
4-2/ Observation
Il se forme de l'eau.
Il se forme le dioxyde du carbone.
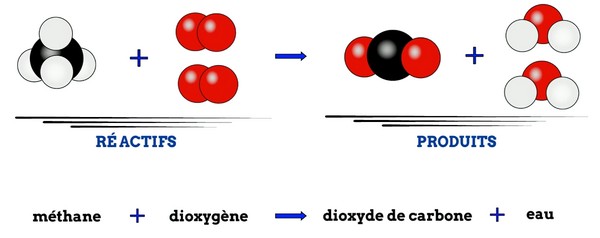
4-3/ Conclusion
La combustion du méthane dans le dioxygène est une transformation chimique.
Le bilan de cette transformation est donc :
V- Conclusion
La transformation chimique est due à la réaction chimique entre les réactifs.
Une réaction chimique décrit une transformation chimique entre un état initial et un état final.
On peut donc dire que la transformation chimique est modélisée par une réaction chimique.
Une réaction chimique est représentée au niveau atomique par une équation chimique appelée Équation de réaction chimique.
VI- Exercices
6-1/ Exercice 1
- Placer les mots suivants dans la bonne place :
chimique - physique - produits - réactifs
Lors d’une transformation __________________ , aucune substance ne disparaît, aucune substance nouvelle n’apparaît, seule l’état physique change
Lors d’une transformation __________________ , des substances disparaissent. Ce sont les __________________ . D’autres substances apparaissent. Ce sont les __________________ .
- Parmi les transformations suivantes, distinguer celles qui sont physiques et celle qui sont chimique:
- La solidification de l’eau
- La combustion incomplète du butane
- La vaporisation de l’eau
- La combustion du carbone
- La combustion complète
VI- Exercices
6-2/ Exercice 2
- Écrire l’équation de la réaction chimique pour chacune des transformations chimique ci-dessous :
| Réactifs | Produits | Équation de la réaction chimique |
|
|
|
|
|
VI- Exercices
6-3/ Exercice 3
La combustion complète du butane est représentée par le modèle moléculaire suivant :
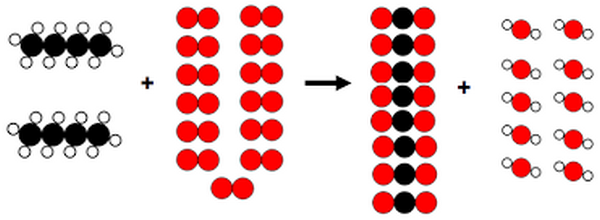
- Écrire les formules de la molécule du butane.
- Énumérer les molécules rentrant dans la combustion.
- Écrire l’équation de la réaction ayant lieu.
VI- Exercices
6-4/ Exercice 4
On renferme dans une bouteille de plastique un échantillon de calcaire auquel on a ajouté de l’acide chlorhydrique que l’on pose sur une balance électronique.
Le morceau de calcaire a disparu et la bouteille en plastique devient gonflée.
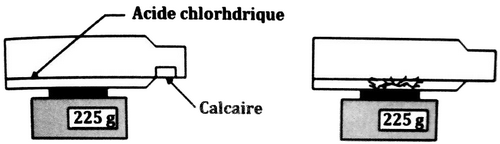
- Interpréter l’indication de la balance.
On ouvre la bouteille pour la dégonfler en la gardant sur la balance, sans que le liquide coule, la balance indique .
- Interpréter.
- À quoi correspond la différence ?


